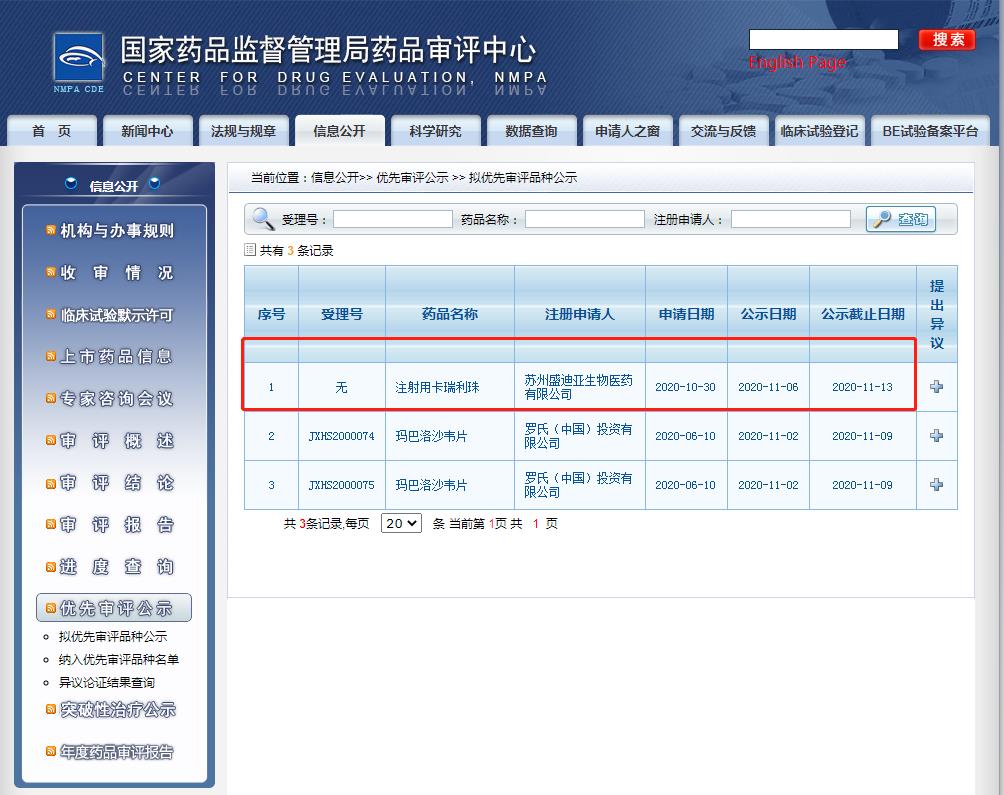
2020年11月6日,國家藥監(jiān)局藥品審評(píng)中心(CDE)網(wǎng)站公示信息顯示,恒瑞醫(yī)藥的注射用卡瑞利珠單抗擬納入優(yōu)先審評(píng)審批程序。
截圖來源:CDE官網(wǎng)
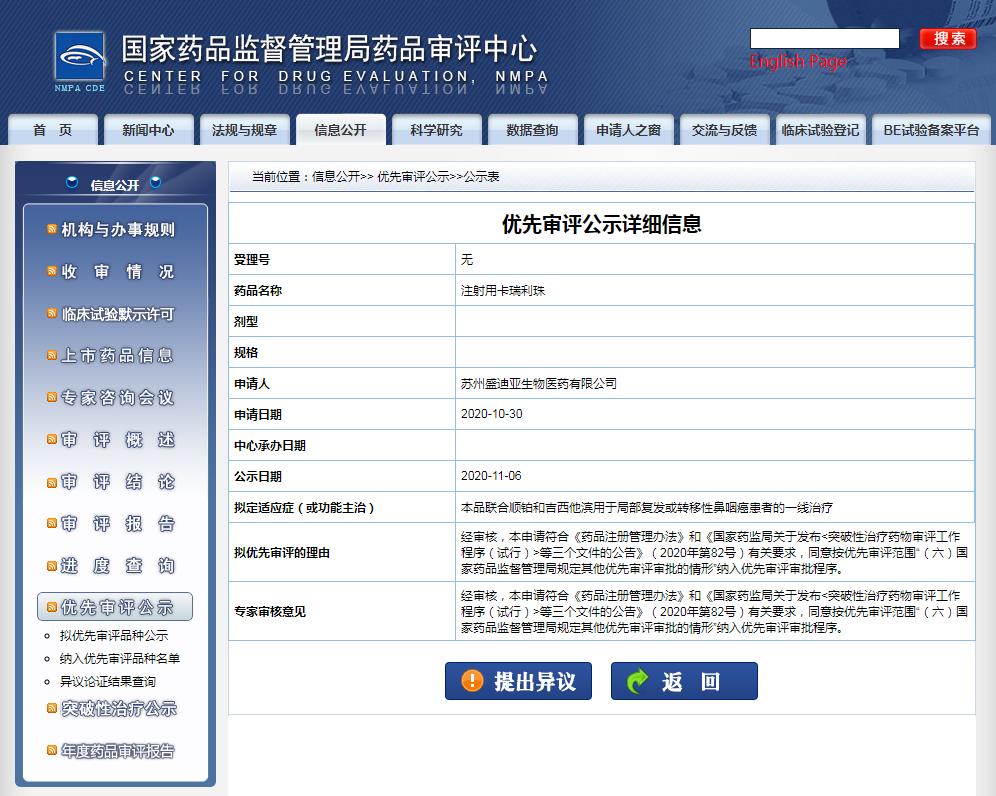
卡瑞利珠單抗是恒瑞醫(yī)藥自主研發(fā)的一款人源化PD-1單克隆抗體,本次擬定適應(yīng)癥(或功能主治)為:本品聯(lián)合順鉑和吉西他濱用于局部復(fù)發(fā)或轉(zhuǎn)移性鼻咽癌患者的一線治療。
擬優(yōu)先審評(píng)的理由是:同意按優(yōu)先審評(píng)范圍“(六)國家藥品監(jiān)督管理局規(guī)定其他優(yōu)先審評(píng)審批的情形”納入優(yōu)先審評(píng)審批程序。
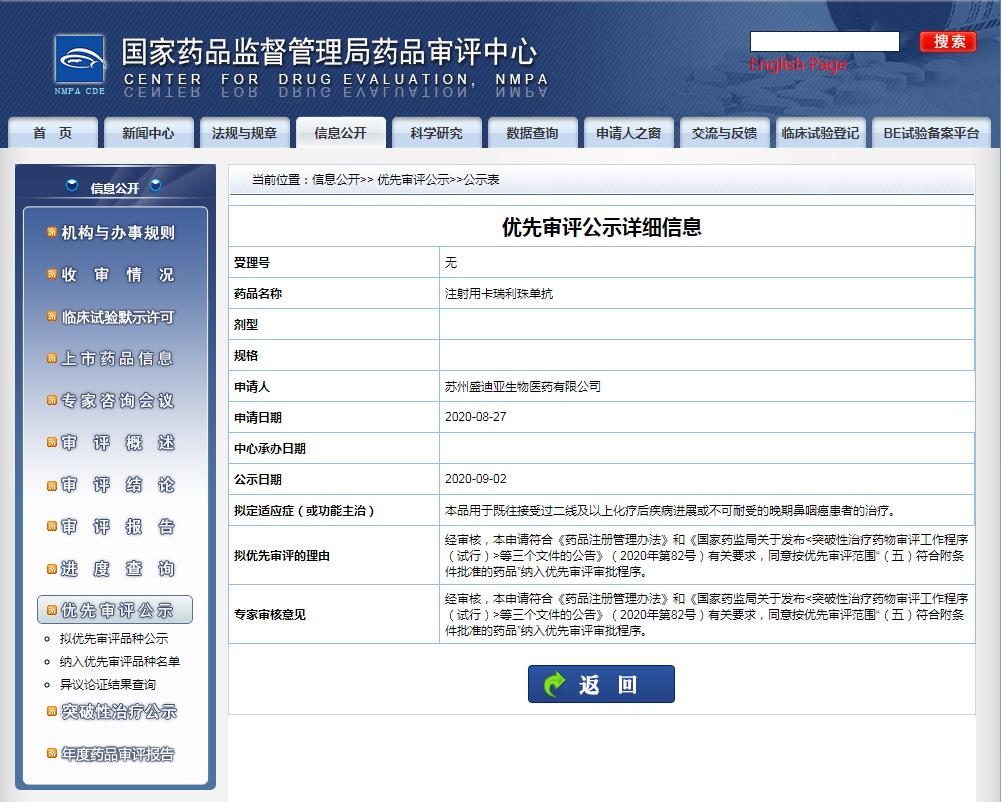
值得一提的是,在今年的9月份,卡瑞利珠單抗“用于既往接受過二線及以上化療后疾病進(jìn)展或不可耐受的晚期鼻咽癌患者的治療”的申請,已因“符合附條件批準(zhǔn)的藥品”被CDE納入優(yōu)先審評(píng)。
截圖來源:CDE官網(wǎng)
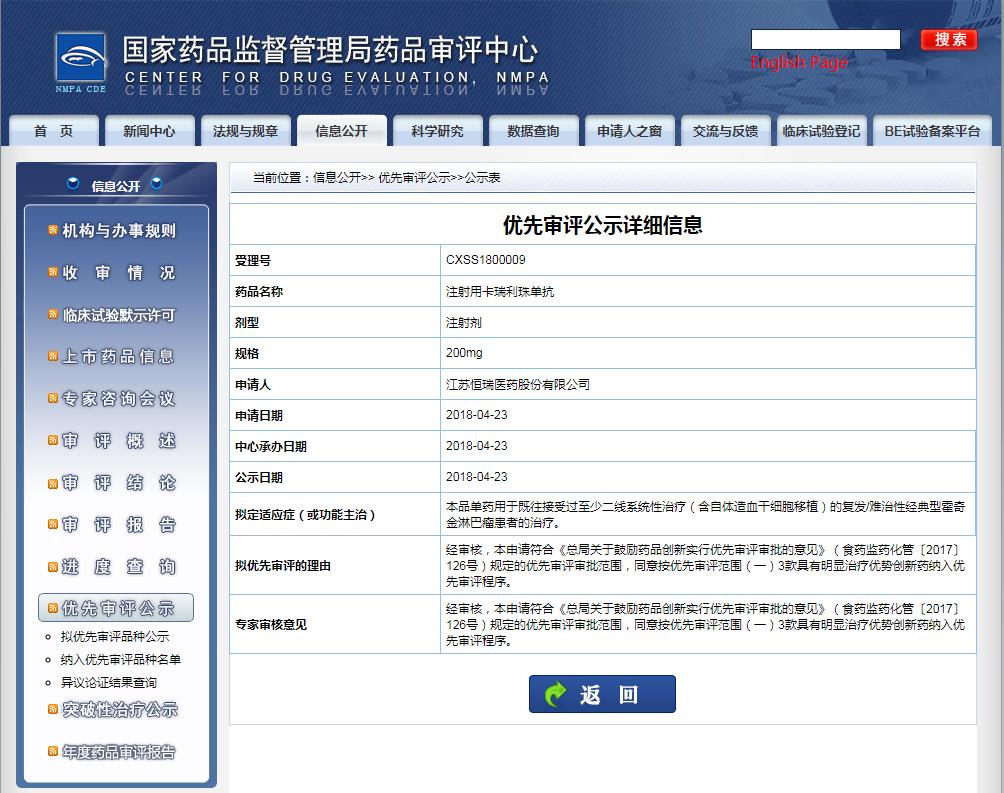
卡瑞利珠單抗是恒瑞醫(yī)藥是恒瑞醫(yī)藥旗下的重點(diǎn)研發(fā)產(chǎn)品,自2019年5月首次在中國獲批上市以來,目前已在中國獲批四個(gè)適應(yīng)癥,分別為:
1)用于至少經(jīng)過二線系統(tǒng)化療的復(fù)發(fā)或難治性經(jīng)典型霍奇金淋巴瘤患者的治療;
截圖來源:CDE官網(wǎng)
2)用于既往接受過標(biāo)準(zhǔn)系統(tǒng)性治療后疾病進(jìn)展或不可耐受的晚期肝細(xì)胞癌患者的治療;

截圖來源:CDE官網(wǎng)
3)聯(lián)合培美曲塞和卡鉑用于EGFR基因突變陰性和ALK陰性的、不可手術(shù)切除的局部晚期或轉(zhuǎn)移性非鱗狀非小細(xì)胞肺癌的一線治療;
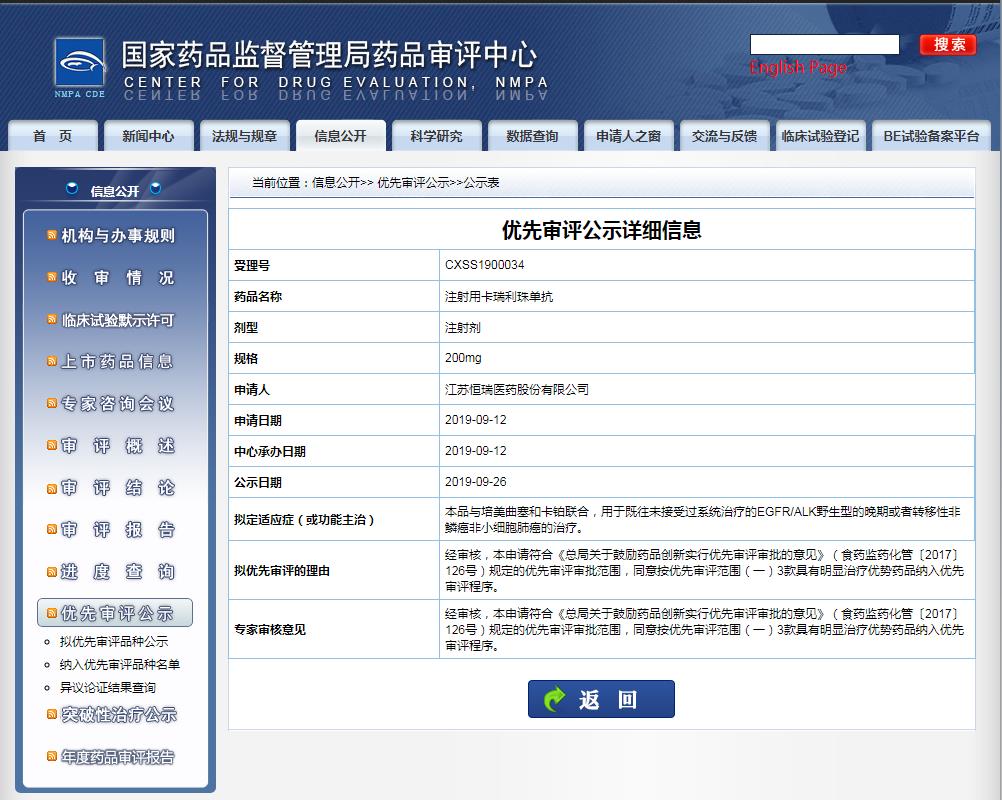
截圖來源:CDE官網(wǎng)
4)用于既往接受過一線標(biāo)準(zhǔn)化療后疾病進(jìn)展或不可耐受的局部晚期或轉(zhuǎn)移性食管鱗癌患者的治療。

截圖來源:CDE官網(wǎng)
卡瑞利珠單抗針對不同鼻咽癌適應(yīng)癥是申請被納入優(yōu)先審評(píng)以及擬優(yōu)先審評(píng)意味著,該藥有望惠及更多的癌癥患者。
鼻咽癌是中國高發(fā)腫瘤之一。放射治療是治療早期鼻咽癌的主要方法,但大約20%-37%的患者會(huì)出現(xiàn)局部復(fù)發(fā)或者遠(yuǎn)處轉(zhuǎn)移。復(fù)發(fā)或轉(zhuǎn)移鼻咽癌的治療手段非常有限,預(yù)后較差,目前一線標(biāo)準(zhǔn)治療一般是含鉑雙藥化療,患者無進(jìn)展生存期為7個(gè)月左右。中國鼻咽癌患者亟需更多的治療手段延長生存期。
祝賀恒瑞醫(yī)藥卡瑞利珠單抗一線治療晚期鼻咽癌的新適應(yīng)癥申請擬被納入優(yōu)先審評(píng),希望該藥早日獲批,給中國鼻咽癌患者帶來新的希望。
訂購需求
- *聯(lián)系人
- *聯(lián)系電話
- *咨詢品種
- 特殊備注
如緊急,請撥打
400-168-0606電話咨詢。




